Hoffnung auf neue Antibiotika
21. Januar 2015
Deutsch-französische Forschergruppe löst das Strukturrätsel um Albicidin – Förderung durch den TU-Exzellenzcluster UniCat – Veröffentlichung in „Nature Chemical Biology“
Wissenschaftler der TU Berlin und des CIRAD Instituts in Montpellier haben nach 30 Jahren das Rätsel um die Struktur des hochpotenten Antibiotikums und Pathogenitätsfaktors Albicidin gelöst. Sie legen damit den Grundstein für weitere Forschungen auf der Suche nach neuen Antibiotika gegen resistente Keime.
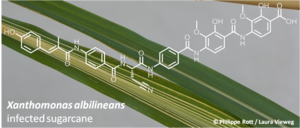
Albicidin wurde erstmals 1985 von einer US-australischen Gruppe beschrieben, die an der Zuckerrohrpflanze forschte. Sie konnte zeigen, dass das Bakterium Xanthomonas albilineans Zuckerrohr befällt und durch die Freisetzung des Metaboliten Albicidin die Entwicklung der Blattstreifigkeit hervorruft, einer Krankheit des Zuckerrohrs, die zum Absterben der Pflanze führt (sugarcane leaf scald disease). Zunächst bildet die Pflanze die namensgebenden weißen Streifen auf seinen Blättern aus und stirbt dann ab. Die Infektion mit dem Erreger Xanthomonas albilineans ist die häufigste bakterielle Erkrankung des Zuckerrohrs. Der stark krankheitsanfälligen Kultivierung des Zuckerrohrs steht heute ein stetig wachsender weltweiter Bedarf gegenüber: 1,8 Milliarden Tonnen allein im Jahr 2012 für die Herstellung von Zucker und Bioethanol.
Doch eine weitere Eigenschaft des Albicidin, neben seiner Funktion bei der Entwicklung der Blattstreifigkeit, hat die Forscher in den letzten Jahrzehnten besonders fasziniert: seine starke antibakterielle Wirkung, insbesondere gegen gramnegative Bakterien. Obwohl keinerlei profundes Wissen über die Struktur des Albicidins bekannt war, wirkten Präparationen, die Albicidin enthielten, sehr stark gegen eine Vielzahl humanpathogener Keime, also gegen Erreger, die beim Menschen Krankheiten hervorrufen. Albicidin ist in der Lage, die Vervielfältigung der bakteriellen DNA zu blockieren, allerdings auf einem anderen Weg als herkömmliche Antibiotika aus diesem Wirkbereich, und dadurch deutlich potenter. Genauere Kenntnisse zur molekularen Struktur des Albicidins, die unabdingbar sind, um diese Eigenschaft dem Menschen nutzbar zu machen, fehlten allerdings bisher.
Einsatz gegen Infektionen mit gramnegativen Bakterien
30 Jahre nach der Erstbeschreibung des Albicidins, ist es den Forschern um Prof. Dr. Roderich Süssmuth von der TU Berlin mit Dr. Monique Royer und Dr. Stéphane Cociancich vom CIRAD Institut in Montpellier nun gelungen, dessen Struktur endgültig aufzuklären: Es handelt sich bei Albicidin um ein äußerst ungewöhnliches lineares Acyl-Peptid mit einem auffälligem Muster untypischer aromatischer nicht-proteinogener Aminosäuren. Zusätzliche biosynthetische Analysen konnten die Strukturaufklärung weiter untermauern und aufzeigen, dass nicht nur die molekulare Struktur des Albicidins, sondern auch dessen Biosynthese in Xanthomonas albilineans so bisher einzigartig sind (Nature Chemical Biology, 2014). Zudem ist es in einer Folgepublikation gelungen, die nicht triviale chemische Synthese dieses komplexen Moleküls zu beschreiben (Angewandte Chemie International Edition, 2014), die die Grundlage für die weitere Forschung an Albicidin bilden wird. Zudem konnte gezeigt werden, dass Albicidin resistenzbrechend ist und gegen Chinolon-resistente Escherichia coli-Stämme eine unveränderte Aktivität aufweist. Dies ist von besonderer Bedeutung, da Chinolone als Breitbandantibiotika in der Medizin vielfältig eingesetzt werden können, zum Beispiel bei der Behandlung von Anthrax. Es treten jedoch vermehrt Resistenzen auf, ein Umstand der den Bedarf an neuen Antibiotika mit ähnlichem Wirkspektrum zusätzlich erhöht.
Diese Ergebnisse sind das Produkt einer engen interdisziplinären Zusammenarbeit zwischen Pflanzenphysiologen, Naturstoff- und Synthesechemikern sowie Molekularbiologen. „Das zeigt, dass es sich lohnt, gerade an schwierigen und komplexen Problemen mehrere Jahre intensiv und mit Hochdruck zu arbeiten“, so Prof. Dr. Roderich Süssmuth. „Ohne die Förderung durch den deutschen Exzellenzcluster UniCat, der an der TU Berlin angesiedelt ist, und die französische ANR wäre es nicht möglich gewesen, das Projekt erfolgreich zu bearbeiten.“ Eine Förderung durch ein DFG-Projekt im Normalverfahren war zunächst nach zwei Jahren eingestellt worden. Für eine mögliche marktwirtschaftliche Verwertung haben die Forscherinnen und Forscher ein umfangreiches Patent verfasst. „Wir haben neben wirtschaftlichen Aspekten der Patentverwertung, von der die TU Berlin profitieren würde, geradezu die moralische Verpflichtung bei dem derzeit dringenden Bedarf an neuen Antibiotika, eine Entwicklung des Wirkstoffes voranzutreiben“, meint Professor Süssmuth. „Allerdings stellt ein solches Vorhaben eine extrem große Herausforderung dar. Die Hürden für eine Wirkstoffentwicklung liegen sehr hoch.“
Das neue Wissen um Albicidin soll in Zukunft genutzt werden, nicht nur das Auftreten der Blattstreifigkeit im Zuckerrohr besser zu verstehen, sondern aus der neuen Leitstruktur des Albicidins einen Wirkstoff für den Einsatz gegen bakterielle Infektionen mit gramnegativen Bakterien zu entwickeln.
Der Exzellenzcluster „Unifying Concepts in Catalysis“ (UniCat)
UniCat ist ein im Rahmen der Exzellenzinitiative des Bundes und der Länder gegründeter interdisziplinärer Forschungsverbund. Sein zentrales Thema ist die Katalyse. UniCat wird von vier Universitäten und zwei Max-Planck-Instituten in Berlin und Potsdam getragen. Etwa 50 Arbeitsgruppen arbeiten gemeinsam und fächerübergreifend an zukunftsrelevanten Forschungsthemen für den Rohstoffwandel und die Energiewende: Von der chemischen Umwandlung von Methan zu Ethylen, der chemischen und biologischen Aktivierung von Kohlendioxid über die katalytische Erzeugung von Wasserstoff aus Wasser mit Sonnenlicht als Energiequelle bis hin zur Synthese von Wirkstoffen mit Hilfe von künstlichen Enzymen. Sprecherhochschule ist die Technische Universität Berlin.
Die Original-Publikation findet man auf folgender Seite:
www.nature.com/nchembio/journal/vaop/ncurrent/full/nchembio.1734.html
Nature Chemical Biology (2015), DOI:10.1038/nchembio.1734
Weitere Informationen erteilt Ihnen gern:
Prof. Dr. Roderich Süssmuth
TU Berlin, Fakultät II Mathematik und Naturwissenschaften, Institut für Chemie
Fachgebiet Organische Chemie, Arbeitskreis Synthetic Biotechnology and Antibiotics
Tel.: 030/314-78774
E-Mail: suessmuth(at)chem.tu-berlin.de
