Das Know-How der Knallgasbakterien nutzen
11. März 2016
UniCat-Wissenschaftler liefern neue Einblicke in die Funktionsweise von Wasserstoff-katalysierenden Enzymen
Hydrogenasen sind Enzyme, die Wasserstoff in Protonen und Elektronen spalten oder Protonen mit Elektronen zu Wasserstoff reduzieren. Ob sie Sauerstoff tolerieren, hängt von ihrer dreidimensionalen Struktur ab. Hierbei scheinen neben der Beschaffenheit der katalytischen Metall-Zentren auch die Anzahl und die Größe bestimmter Kanäle eine wichtige Rolle zu spielen. Zu diesem Schluss kommen Dr. Patrick Scheerer von der Charité – Universitätsmedizin Berlin und Dr. Oliver Lenz von der Technischen Universität Berlin. Die Ergebnisse der Studie, die im UniCat-Forschungsfeld E3 entstanden sind, sind in der aktuellen Ausgabe der Fachzeitschrift Angewandte Chemie veröffentlicht.
Wasserstoff gilt als Energieträger der Zukunft. Bei der Verbrennung von Wasserstoff mit Sauerstoff, der sogenannten Knallgasreaktion, wird mit 286 kJ/mol ein sehr hohes Maß an Energie freigesetzt. Einige anaerobe Mikroorganismen, also solche, die ohne Sauerstoff leben, verwenden Wasserstoff als Energiequelle, indem sie ihn mittels Hydrogenasen oxidieren und so die im Wasserstoff gebundene Energie nutzen. Andere Mikroorganismen wiederum setzen ihre überschüssige Energie in Form von Wasserstoff frei, ebenfalls mithilfe einer Hydrogenase.
„Eine Besonderheit der Hydrogenasen ist ihre Empfindlichkeit gegenüber Sauerstoff. Dieser kann das katalytische Zentrum des Enzyms irreversibel beschädigen“, sagt Arbeitsgruppenleiter Dr. Patrick Scheerer vom Institut für Medizinische Physik und Biophysik der Charité. „Eine Ausnahme bilden beispielsweise bestimmte aerob lebende H2-oxidierende Bakterien, die sogenannten Knallgasbakterien. Sie haben sich darauf spezialisiert, Wasserstoff in einer sauerstoffhaltigen Umgebung zu verarbeiten“, fügt er hinzu. In der aktuellen Untersuchung wollten die Forscher herausfinden, was die Hydrogenase der Knallgasbakterien resistenter gegenüber Sauerstoff macht.
Eine detaillierte Charakterisierung der sauerstofftoleranten Hydrogenasen ist von Bedeutung, weil sie eine neue Perspektive für den Einsatz dieser Enzyme in der Photosynthese-getriebenen Produktion von Bio-Wasserstoff aus Licht und Wasser eröffnet. Aber auch als Stromlieferanten in Enzymatischen Brennstoffzellen sind sauerstofftolerante Hydrogenasen von großer Relevanz.
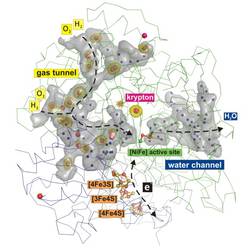
Mithilfe verschiedener Methoden wie der Edelgas-Derivatisierung von Proteinkristallen und einer Röntgenstrukturanalyse untersuchten die Wissenschaftler die dreidimensionale Struktur des Proteins. Sie analysierten zudem die Wege, Länge und Größe der hydrophoben, also wasserabweisenden Gastunnel, welche die Zugänglichkeit von Substraten zum innenliegenden aktiven Zentrum des Enzyms ermöglichen. In einem weiteren Schritt verglichen die Forscher die Struktur von sauerstofftoleranten und sauerstoffsensitiven Hydrogenasen mittels Modellberechnungen. „Unsere Ergebnisse zeigen wesentliche Unterschiede in der Anzahl und Größe der hydrophoben Gastunnel zwischen den Hydrogenasen. Diese Unterschiede sind womöglich ein wichtiger Grund für die bemerkenswerte Eigenschaft der Sauerstofftoleranz“, kommentiert Jacqueline Kalms, Erstautorin der Studie, die Ergebnisse.
Originalarbeit
Ein Netzwerk aus hydrophoben Tunneln zum Transport gasförmiger Reaktanten in einer O2-toleranten, membrangebundenen [NiFe]- Hydrogenase, aufgedeckt durch Derivatisierung mit Krypton. Kalms J, Schmidt A, Frielingsdorf S, van der Linden P, von Stetten D, Lenz O, Carpentier P, Scheerer P. Angew. Chem. 2016 Feb 23. DOI: 10.1002/ange.201508976.
Kontakt
Dr. Patrick Scheerer
Institut für Medizinische Physik und Biophysik
AG Proteinstrukturanalyse und Signaltransduktion
Charité - Universitätsmedizin Berlin
t: +49 30 450 524 178
Dr. Julia Biederlack
Geschäftsbereich Unternehmenskommunikation
Charité – Universitätsmedizin Berlin